메디컬 B2B 플랫폼 스타트업 메디히어로즈가 코로나19 진단 팩트 체크를 공개했다. 메디히어로즈는 전 세계 코로나19 진단 제품은 약 275개에 달하고, 그중 한국산 제품이 중국산 다음으로 두 번째 많다고 밝혔다.
메이드인 코리아 의료 제품과 코로나19 진단 키트에 대한 전 세계적인 관심이 뜨겁다. 주식 시장에서도 코로나 관련 메디컬 회사들이 연일 새로운 역사를 쓰고 있다.
◇전 세계 사용 중인 코로나 진단 제품 약 275개 달해
31일 기준 세계보건기구의 진단 기술 평가 협력 기관 중 하나인 FIND 사이트에 따르면, 분자진단 검사 제품과 면역진단 검사 제품 모두 합쳐 약 275개 코로나 진단 제품이 전 세계적으로 사용되고 있으며, 이 외에도 추가 개발 중인 코로나 진단 제품만도 수 십 개에 달한다.
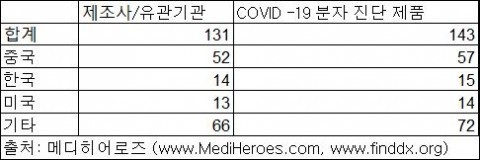
그 중 분자진단 제품은 3월 31일 현재 총 131개의 기관에서 143개의 제품을 상업적으로 판매 사용하는 것으로 파악되며, 중국산 제품이 총 57개, 한국산 제품이 총 15개, 미국산 제품이 총 14개로 집계됐다.
◇미국 식품의약국(FDA) 긴급 사용 승인제품 총 22개
미국 식품의약국(FDA) 사이트를 살펴보면 총 22개 기관이 개발한 22개 COVID-19 진단 제품이 긴급 사용 승인(Emergency Use Authorization, EUA)을 받았으며, 이 리스트에 이름을 올린 한국 제품은 아직 없다.
국내 언론 보도에 따르면 3월 28일 외교부가 공개한 미국 식품의약국(FDA)으로부터 잠정 승인 또는 사전 승인이라는 용어에 대해 국내에서 여러가지 논란이 있었다. 진단 제품 제조사가 아니더라도, 고난이도 진단 역량을 보유한 검진센터가 연구용 진단 제품을 직접 구매하여, 자체적으로 코로나 검진을 할 수 있다는 얘기다.
메디히어로즈는 미국 FDA에 따르면, 긴급 사용 승인(EUA)을 준비하는데 약 15일(15 business days) 정도면 충분할 것으로 보고 있기 때문에, 외교부가 사전 승인을 받았다고 언급한 세 가지 국산 진단 제품 외에 다른 국산 제품들도 머지않아 미국 식품의약국(FDA) 긴급 사용 승인 리스트에 이름을 올릴 것으로 내다봤다.










